摘要
本文翻译自 戊酸雌二醇 - 维基百科 (wikipedia.org)。 目的是为跨性别女性提供更好的用药资料,和解答相关的疑惑。
翻译进度
总完成度 60%
| 文档正文 | 翻译已完成 | |
| 引用 | 完成度30% | |
| 图片 | 完成度10% | |
| 摘要与分析 | 完成度0% |
本文翻译自 戊酸雌二醇 - 维基百科 (wikipedia.org)。 目的是为跨性别女性提供更好的用药资料,和解答相关的疑惑。
总完成度 60%
| 文档正文 | 翻译已完成 | |
| 引用 | 完成度30% | |
| 图片 | 完成度10% | |
| 摘要与分析 | 完成度0% |
戊酸雌二醇
戊酸雌二醇是一种雌二醇酯,也是雌二醇的前体药物。[1][2] 它是一种雌激素,亦即雌激素受体激动剂。[2:1][1:1] 戊酸雌二醇对雌激素受体的亲和力仅为雌二醇的约五十分之一。[3]此外,戊酸雌二醇迅速裂解成雌二醇,因此无法以足够的浓度到达靶组织(如果有的话)。[3:1] 因此,戊酸雌二醇基本没有雌激素作用活性,仅作为雌二醇的前体药物存在。[3:2]。 由于其C17β戊酸酯的存在,戊酸雌二醇的分子量约为雌二醇的131%,因此戊酸雌二醇含有等剂量雌二醇的约76%的雌二醇量。[4][5] 除去为适应分子量的差异而进行的剂量调整后,口服戊酸雌二醇被认为等同于口服雌二醇。由于戊酸雌二醇是雌二醇的前药, 它被认为是雌激素的天然和生物同质形式.[1:2][6][7]
| 雌激素 | 其他名称 | 雌激素受体(ERs) | Erα | ERβ |
|---|---|---|---|---|
| 雌二醇 | E2 | 100 | 100 | 100 |
| 雌二醇 3-葡糖苷酸 | E2-3G | ? | 0.02 | 0.09 |
| 3-硫酸雌二醇 | E2S; E2-3S | ? | 0.02 | 0.04 |
| 雌二醇17β-乙酸酯 | E2-17A | 31–45 | 24 | ? |
| 雌二醇17β-葡糖苷酸 | E2-17G | ? | 0.002 | 0.0002 |
| 苯甲酸雌二醇 | EB; Estradiol 3-benzoate | 10 | 1.1 | 0.52 |
| 环戊丙酸雌二醇 | EC; Estradiol 17β-cypionate | ?c | 4 | ? |
| 雌二醇二乙酸酯 | EDA; Estradiol 3,17β-diacetate | ? | 0.79 | ? |
| 棕榈酸雌二醇 | Estradiol 17β-palmitate | 0 | ? | ? |
| 丙酸雌二醇 | EP; Estradiol 17β-propionate | 19–26 | 2.6 | ? |
| 硬脂酸雌二醇 | Estradiol 17β-stearate | 0 | ? | ? |
| 戊酸雌二醇 | EV; Estradiol 17β-valerate | 2–11 | 0.04–21 | ? |
| 雌酮 | E1; 17-Ketoestradiol | 11 | 5.3–38 | 14 |
| 葡糖苷酸雌酮 | E1G; Estrone 3-glucuronide | ? | <0.001 | 0.0006 |
| 硫酸雌酮 | E1S; Estrone 3-sulfate | 2 | 0.004 | 0.002 |
| 乙炔雌二醇 | EE; 17α-Ethynylestradiol | 100 | 17–150 | 129 |
| 间苯二醇 | EE 3-methyl ether | 1 | 1.3–8.2 | 0.16 |
| 炔雌醇环戊醚 | EE 3-cyclopentyl ether | ? | 0.37 | ? |
口服2 mg/天的戊酸雌二醇对凝血因子的影响小于10 μg/天口服炔雌醇。[8][9][10][11][12]已发现10 μg/天的口服炔雌二醇对HDL胆固醇和甘油三酯的影响约为2mg /天的口服戊酸雌二醇的1.5至2.5倍。[13][14][15] 20或50μg/天口服炔雌醇对凝血因子和HDL胆固醇的影响显著大于2mg/天的口服戊酸雌二醇。[13:1][16]
含有雌二醇的避孕药含有 1~3mg/天 的雌二醇或戊酸雌二醇,已被发现可将性激素结合球蛋白 (SHBG) 水平提高 1.5 倍。[17][18]已发现口服戊酸雌二醇6毫克/天可使跨性别女性的SHBG水平增加2.5至3倍。[19][20]为了进行比较,已经发现含有炔雌醇和具有最小雄激素或抗雄激素活性的孕激素的复方避孕药可使SHBG水平增加约3至4倍。[21]
无论给药途径如何,戊酸雌二醇都通过被酯酶裂解成雌二醇和天然脂肪酸戊酸而发挥雌二醇的前体作用。这种裂解不仅发生在肝脏中,还发生在血液和组织中,并且无论药物是口服还是肠外给药,戊酸雌二醇的水解都是完全的。静脉注射戊酸雌二醇后在内循环中发现高水平的雌二醇,这表明药物在进入循环时就非常快速地裂解了。
戊酸雌二醇中,雌二醇C17β位置的酯化降低了17β-羟基类固醇脱氢酶(17β-HSD)对戊酸雌二醇的代谢。由于大约 80% 的雌二醇在肝脏的首过效应中被 17β-HSD 代谢成雌酮和硫酸雌酮,这提高了戊酸雌二醇的代谢稳定性和生物利用率。然而,戊酸雌二醇在肠道中水解成雌二醇和戊酸,因此仍然会受到首过效应的广泛影响。因此,戊酸雌二醇的口服生物利用率仅为 3% 至 5% 左右,与口服雌二醇相似。采用雌二醇和戊酸雌二醇的所有口服片剂似乎都是微粉化的。 由于其作为前体药物能快速转化为雌二醇的性质,口服戊酸雌二醇的药代动力学与口服雌二醇的药代动力学相似。此外,口服戊酸雌二醇的药效学和效力(在考虑分子量差异后)被认为与口服雌二醇的药效学和效力相同。同样,在考虑两种化合物之间的分子量差异之后,对于肝蛋白合成(例如SHBG)的影响也是如此。
已发现口服1 mg/天剂量的戊酸雌二醇可产生大约 50 pg/mL 雌二醇和 160 pg/mL 雌酮的血药浓度,而 2 mg/天的剂量产生循环水平为 60 pg/mL 雌二醇和 300 pg/mL 雌酮。 这些雌二醇和雌酮的浓度与口服 1 和 2 mg/天雌二醇时观察到的浓度相当。对选定研究的综述报告了在给予 2 mg 口服戊酸雌二醇后 1 至 12 小时发生 24 至 140 pg/mL 的平均雌二醇峰值水平范围。一项研究发现, 由于它们的分子量差异, 口服雌二醇产生的雌二醇水平高于口服戊酸雌二醇. 同样,其他研究发现,口服大致等摩尔剂量的雌二醇(1.5毫克)和戊酸雌二醇(2毫克)后,雌二醇和雌酮的水平非常相似。一项关于高剂量口服戊酸雌二醇的研究发现,三名女性单次服用10mg戊酸雌二醇后,雌二醇水平约为250pg/mL。
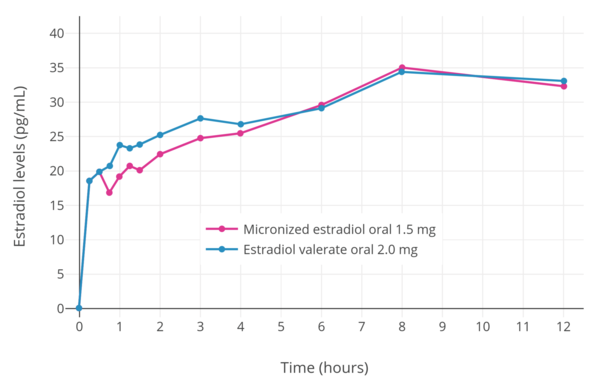 |
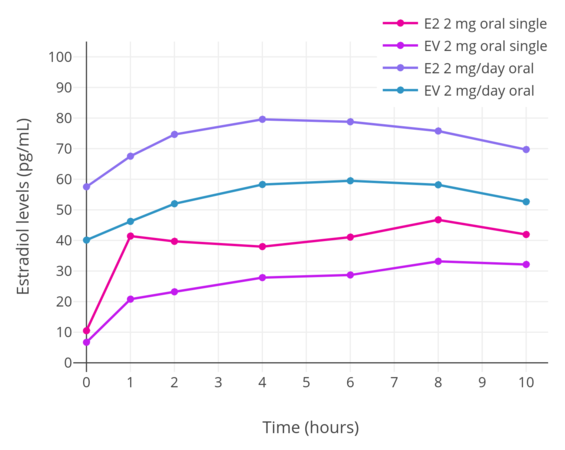 |
| 绝经后妇女单次口服剂量1.5mg微粉化雌二醇或2.0mg戊酸雌二醇后的基线调整雌二醇水平。资料来源:Timmer & Geurts (1999) | 绝经后妇女单次口服剂量2mg微粉化雌二醇或2mg戊酸雌二醇后,以及连续口服2mg/天微粉化雌二醇或2mg/天戊酸雌二醇(稳态)后的雌二醇水平。资料来源Wiegratz et al. (2001) |
通过绝经前妇女舌下给药,已经对戊酸雌二醇进行了研究,用于捐卵和代孕中的月经周期控制和排卵抑制。 已经针对该适应症以及阴道给药和透皮雌二醇进行了研究,因为口服戊酸雌二醇有时无法达到足够的雌二醇水平,在这种情况下无法进行适当的生理周期控制。戊酸雌二醇的舌下给药绕过了口服途径发生的首过效应,并得到更高水平的雌二醇和更好的生理周期控制。舌下含服戊酸雌二醇也用于跨性别女性的激素治疗。
已发现每天舌下含服2mg口服微粉化戊酸雌二醇片剂(Progynova,Schering)3或4次,绝经前妇女的循环雌二醇水平约为290pg/mL至460pg/mL(未给出测量时间)。雌二醇的稳态在约2或3天内达到。黄体酮,LH和FSH的水平都受到显着抑制,排卵以及相关的周期中期的激素达峰也被阻遏。与口服雌二醇类似、但与阴道和透皮途径相反的是,雌二醇与雌酮的比例随着戊酸雌二醇或雌二醇的舌下给药而降低。
与口服给药相反,肌内注射戊酸雌二醇的生物利用率是完全的(即100%)。由于肌内注射戊酸雌二醇相对于口服的生物利用度要高得多,就效力而言前者比后者强得多。例如,据称单次肌内注射 4 mg 戊酸雌二醇大约相当于 3 周的2mg/天口服给药。当在油溶液中肌内给药时,戊酸雌二醇形成肌内储存库,药物从中缓慢释放和吸收,因此持续时间相对较长。在油溶液中肌内注射戊酸雌二醇时,溶剂(即油)被吸收,并且在注射部位的肌肉内形成初级微晶库。此外,还可以在脂肪组织中形成二级库。戊酸雌二醇的缓慢释放是由药物的亲脂性增加引起的,这又是由于其戊酸酯部分。肌内注射油(商品名Estradiol-Depot 10 mg,Progynon Depot-10)中戊酸雌二醇的生物半衰期约为 3.5 天,在不同的个体中范围为 1.2 天至 7.2 天。1980 年代的较早的几项样本量仅为2~3人的研究报告生物半衰期为 4 至 5 天。
已发现单次肌内注射 4 mg 戊酸雌二醇可在给药后 3 天内得到的雌二醇的最大循环浓度约为 390 pg/mL,水平在 12 至 13 天后降至 100 pg/mL(研究中的基线)。 一般研究发现,单次肌内注射 4 毫克戊酸雌二醇导致雌二醇的峰值水平在给药后 1~5天内出现,为240 至 540 pg/mL。一项研究发现,单次肌内注射 5 mg 戊酸雌二醇分别在大约 2 天和 3 天内达到 667 pg/mL 雌二醇和 324 pg/mL 雌酮的峰值水平。戊酸雌二醇在该剂量和本研究中的持续时间被认为是 7 至 8 天。其他研究发现, 超过 20 毫克的较大剂量的肌内注射戊酸雌二醇,持续时间超过 15 天。与之前的研究相反,第三项研究发现,单次 10 毫克肌内注射戊酸雌二醇导致绝经后妇女的最大雌二醇水平为 506 至 544 pg/mL,最大雌酮水平为 205 至 219 pg/mL。
肌内注射戊酸雌二醇,据报道,5mg的剂量持续时间为7至8天,10mg持续时间为10至14天,40mg持续时间为2至3周(14至21天),100mg持续时间为3至4周(21至28天)。
一项关于雌激素缺乏症女性肌内注射 40 mg/周的戊酸雌二醇和 250 mg/周的己酸羟孕酮的假妊娠研究发现,治疗 3 个月时雌二醇水平约为 3,100 pg/mL,治疗 6 个月时雌二醇水平约为 2,500 pg/mL。
戊酸雌二醇和环戊丙酸雌二醇等雌二醇酯可以通过皮下注射而不是肌肉注射给予。
已研究通过静脉注射给予戊酸雌二醇。目前已经发现它将会非常迅速地裂解成雌二醇。戊酸雌二醇的生物利用度和代谢与静脉注射与肌内注射没有差异。相反的是,静脉注射戊酸雌二醇仅具有非常短的持续时间,而肌内注射具有较长的持续时间和生物半衰期。
迈克尔·奥特尔;埃克哈德·席林格(2012年12月6日)。雌激素和抗雌激素II:雌激素和抗雌激素的药理学和临床应用。施普林格科学与商业传媒。第261页。ISBN 978-3-642-60107-1:这里考虑的天然雌激素包括:[…]17β-雌二醇的酯,如戊酸雌二醇、苯甲酸雌二醇和环戊丙酸雌二醇。酯化的目的是在口服给药后更好地吸收或在肌注给药后持续释放。在吸收过程中,酯被内源性酯酶裂解并释放药理活性17β-雌二醇;因此,酯被认为是天然雌激素。 ↩︎ ↩︎ ↩︎
库尔 H (2005)。“雌激素和孕激素的药理学:不同给药途径的影响”(PDF)。 Climacteric . 8 Suppl 1: 3–63. doi:10.1080/13697130500148875.PMID 16112947。S2CID 24616324。 ↩︎ ↩︎
Düsterberg B, Nishino Y (1982年12月). “戊酸雌二醇的药代动力学和药理学特征”. Maturitas . 4 (4): 315–24. doi:10.1016/0378-5122(82)90064-0. PMID 7169965. ↩︎ ↩︎ ↩︎
J. Elks (2014年11月14日)。《药物词典:化学数据:化学数据,结构和参考书目》。斯普林格。第898页-。 ISBN 978-1-4757-2085-3. ↩︎
索引名称2000:国际药品目录。Taylor & Francis US. 2000年,第405页。 ISBN978-3-88763-075-1。检索于2012年5月20日。 ↩︎
Cirigliano M (June 2007). “Bioidentical hormone therapy: a review of the evidence”. J Womens Health (Larchmt) . 16 (5): 600–31. doi:10.1089/jwh.2006.0311. PMID 17627398. ↩︎
Nagrath Arun; Malhotra Narendra; Seth Shikha (15 December 2012). 《Progress in Obstetrics and Gynecology–3》 . Jaypee Brothers Medical Publishers Pvt. Ltd. pp. 419–. ISBN 978-93-5090-575-3. ↩︎
1.Guida M, Bifulco G, Di Spiezio Sardo A, Scala M, Fernandez LM, Nappi C (August 2010). “Review of the safety, efficacy and patient acceptability of the combined dienogest/estradiol valerate contraceptive pill”. International Journal of Women’s Health . 2 : 279–90. doi:10.2147/IJWH.S6954. PMC 2990895. PMID 21151673. ↩︎
Micks EA, Jensen JT (January 2013). “Treatment of heavy menstrual bleeding with the estradiol valerate and dienogest oral contraceptive pill”. Adv Ther . 30 (1): 1–13. doi:10.1007/s12325-012-0071-3. PMID 23239397. S2CID 31125733. ↩︎
Hardman SM, Gebbie AE (July 2009). “Hormonal contraceptive regimens in the perimenopause”. Maturitas . 63 (3): 204–12. doi:10.1016/j.maturitas.2009.05.001. PMID 19524378. ↩︎
Lindberg UB, Crona N, Stigendal L, Teger-Nilsson AC, Silfverstolpe G (February 1989). “A comparison between effects of estradiol valerate and low dose ethinyl estradiol on haemostasis parameters”. Thromb. Haemost . 61 (1): 65–9. doi:10.1055/s-0038-1646528. PMID 2526387. ↩︎
Wiegratz I, Lee JH, Kutschera E, Winkler UH, Kuhl H (August 2004). “Effect of four oral contraceptives on hemostatic parameters”. Contraception . 70 (2): 97–106. doi:10.1016/j.contraception.2004.03.004. PMID 15288212. ↩︎
Trémollieres F (February 2012). “Contraception orale estro-progestative: quelle différence entre éthinylestradiol et estradiol?” [Oral combined contraception: is there any difference between ethinyl-estradiol and estradiol?]. Gynecol Obstet Fertil (in French). 40 (2): 109–15. doi:10.1016/j.gyobfe.2011.10.009. PMID 22244780. ↩︎ ↩︎
L’Hermite M (September 1990). “Risks of estrogens and progestogens”. Maturitas . 12 (3): 215–46. doi:10.1016/0378-5122(90)90005-q. PMID 2170823. ↩︎
Ottosson UB, Carlström K, Johansson BG, von Schoultz B (1986). “Estrogen induction of liver proteins and high-density lipoprotein cholesterol: comparison between estradiol valerate and ethinyl estradiol”. Gynecol. Obstet. Invest . 22 (4): 198–205. doi:10.1159/000298914. PMID 3817605. ↩︎
Fåhraeus L (November 1988). “The effects of estradiol on blood lipids and lipoproteins in postmenopausal women”. Obstet Gynecol . 72 (5 Suppl): 18S–22S. PMID 3173937. ↩︎
Sitruk-Ware R, Nath A (June 2011). “Metabolic effects of contraceptive steroids”. Rev Endocr Metab Disord . 12 (2): 63–75. doi:10.1007/s11154-011-9182-4. PMID 21538049. S2CID 23760705. ↩︎
Fruzzetti F, Trémollieres F, Bitzer J (May 2012). “An overview of the development of combined oral contraceptives containing estradiol: focus on estradiol valerate/dienogest”. Gynecol. Endocrinol . 28 (5): 400–8. doi:10.3109/09513590.2012.662547. PMC 3399636. PMID 22468839. ↩︎
Mueller A, Dittrich R, Binder H, Kuehnel W, Maltaris T, Hoffmann I, Beckmann MW (July 2005). “High dose estrogen treatment increases bone mineral density in male-to-female transsexuals receiving gonadotropin-releasing hormone agonist in the absence of testosterone”. Eur. J. Endocrinol . 153 (1): 107–13. doi:10.1530/eje.1.01943. PMID 15994752. ↩︎
Mueller A, Binder H, Cupisti S, Hoffmann I, Beckmann MW, Dittrich R (March 2006). “Effects on the male endocrine system of long-term treatment with gonadotropin-releasing hormone agonists and estrogens in male-to-female transsexuals”. Horm. Metab. Res . 38 (3): 183–7. doi:10.1055/s-2006-925198. PMID 16673210. ↩︎
Odlind V, Milsom I, Persson I, Victor A (June 2002). “Can changes in sex hormone binding globulin predict the risk of venous thromboembolism with combined oral contraceptive pills?”. Acta Obstet Gynecol Scand . 81 (6): 482–90. doi:10.1034/j.1600-0412.2002.810603.x. PMID 12047300. S2CID 26054257. ↩︎
Q: 为什么诺坤复(雌二醇)需要舌下含服?补佳乐为什么需要戊酸?
A: 对于雌二醇,大约 80% 的雌二醇在肝脏的首过效应中被 17β-HSD 代谢成低活力的雌酮和硫酸雌酮。舌下含服可以显著的降低首过效应,从而增加雌二醇的生物利用率。
戊酸雌二醇中,雌二醇C17β位置的酯化降低了17β-羟基类固醇脱氢酶(17β-HSD)对戊酸雌二醇的代谢。 这提高了戊酸雌二醇的代谢稳定性和生物利用率。
Q: 口服戊酸雌二醇与舌下含服戊酸雌二醇的区别?
A: 戊酸雌二醇在肠道中水解成雌二醇和戊酸,因此仍然会受到首过效应的广泛影响。因此,戊酸雌二醇的口服生物利用率仅为 3% 至 5% 左右,与口服雌二醇相似。
采用雌二醇和戊酸雌二醇的所有口服片剂似乎都是微粉化的。这使得我们可以舌下含服雌二醇绕过肠道分解和肝门静脉,减少首过效应的影响。
由百科,戊酸雌二醇的舌下给药可得到更高水平的雌二醇和更好的生理周期控制。